Une batterie d'accumulateurs permet de stocker l'énergie électrique afin de la restituer par la suite, en fonction des besoins
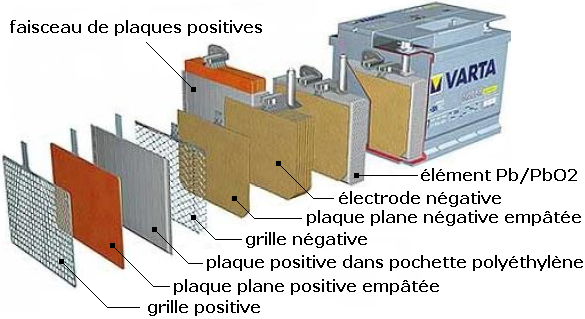
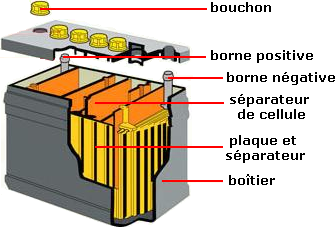
Une batterie au plomb est constituée d'un certain nombre d'éléments accumulateurs montés en série et reliés par des connexions en plomb soudé (une batterie de 12 V contient 6 éléments)
Les accumulateurs sont logés dans un bac en plastique (polypropylène, ABS...), fermé par un couvercle scellé
Chaque accumulateur est composé d'un ensemble de couples d'électrodes positives et négatives isolées par un séparateur microporeux, destiné à éviter les courts-circuits tout en laissant circuler les ions
Les électrodes sont formées d'une grille en alliage de plomb, dont les alvéoles sont remplies d'une pâte poreuse :
- de peroxyde de plomb PbO2 pour l'électrode positive
- de plomb métallique Pb pour l'électrode négative
Les électrodes baignent dans un électrolyte, solution diluée d'acide sulfurique H2SO4, sous forme liquide, sous forme de gel ou absorbée dans des feutres en fibre de verre
|
 |
Il existe 3 principales catégories définies par leur domaine d'application :
- batterie de démarrage : utilisée dans les automobiles, elle est composée de plaques fines, de grande surface, et autorise des courants de décharge élevés, mais de courte durée
- batterie de traction : utilisée dans les chariots élévateurs, elle est formée de plaques plus épaisses et permet des décharges journalières pouvant atteindre 80% de la capacité
- batterie stationnaire : utilisée dans les ASI (alimentations sans interruption), conçue pour fonctionner en "floating" (1)
Ce sont des réactions d'oxydo-réduction : il y a un transfert d'électrons
L'atome qui capte les électrons est appelé oxydant : l'oxydant subit une réduction (à la cathode)
L'atome qui cède les électrons est appelé réducteur : le réducteur subit une oxydation (à l'anode)
Les polarités de la batterie sont alternativement anode ou cathode, suivant le mode de fonctionnement (charge ou décharge) : la borne négative est anode pendant la décharge et cathode pendant la charge
L'électrolyte est une solution d'eau pure et d'acide sulfurique H2SO4 (2H+ ; SO42-)
L'électrode négative est formée de plomb Pb, l'électrode positive d'oxyde de plomb PbO2
La décharge de l’accumulateur au plomb consomme les solides des électrodes et les ions H+ de l’électrolyte (la concentration en acide diminue, le pH augmente)
Pb + PbO2 + 4H+ + 2SO42- La charge de l’accumulateur au plomb forme les solides des électrodes et les ions H+ de l’électrolyte (la concentration en acide augmente, le pH diminue)
2H2O + 2PbSO4 |
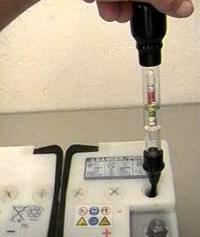
Le pèse-acide permet de contrôler la densité de l'électrolyte des batteries
|
 |
 |
Une batterie au plomb se caractérise essentiellement par :
- sa tension nominale U liée au nombre d'éléments n : U = n x 2,1
si n = 6 => U = 12,6 V - sa capacité de stockage C qui s'exprime en Ah
l'énergie électrique correspondante est E = C x U (si C = 50 Ah et U = 12 V => E = 600 Wh) - son courant maximal I ou courant de crête (en A)
Exemple de caractéristiques techniques
Type |
Tension |
Capacité |
Longueur |
Largeur |
Hauteur |
Poids |
Courant |
Impédance |
||
(V) |
Ah/20h |
Ah/10h |
(mm) |
(mm) |
(mm) |
(Kg) |
(A) 1 mn |
(A) 1 s |
(m ohm) |
|
NPL78-12I |
12 |
78 |
72,5 |
380 |
166 |
177,5 |
28,6 |
500 |
800 |
4 |
NPL100-12 |
12 |
100 |
93 |
407 |
172,5 |
240 |
39 |
600 |
800 |
4 |
NPL130-6I |
6 |
130 |
120,3 |
350 |
166 |
174 |
24 |
500 |
800 |
2 |
NPL200-6 |
6 |
200 |
186 |
398 |
176 |
250 |
39 |
1200 |
1600 |
1,3 |
Pour le type NPL100-12, la capacité est :
- C20 = 100 Ah pour une décharge en 20 heures
- C10 = 93 Ah pour une décharge en 10 heures
Plus la rapidité de la décharge est importante, plus la capacité réelle de la batterie est faible
La batterie NPL100-12 peut fournir 600 A pendant 1 minute et 800 A pendant 1 secconde
D’après la norme NF C 15-100, le courant de court-circuit d’une batterie est : Icc = 10 × Cn
Ce qui donne pour la NPL100-12 : Icc = 10 × 100 = 1000 A
 |
Quand le cycle de charge se termine, un dégagement d'hydrogène et d'oxygène se produit Ce mélange est extrêmement explosif : la présence de flammes ou d'étincelles à proximité d'une batterie en cours de charge est très dangereuse Un local à accumulateurs doit toujours être efficacement aéré |
La capacité réelle d'une batterie diminue avec la température : c'est ce qui explique que
La durée de vie d'une batterie est indiquée par le fabricant |
 |
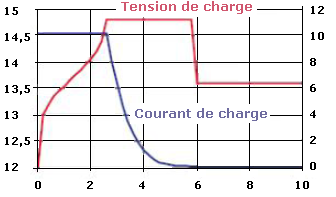
La charge d'une batterie doit se faire de préférence en respectant les 3 phases :
|
 |
|
Causes du vieillissement prématuré d'une batterie
- décharge profonde (80% de la capacité C20) : les batteries en état de décharge complète doivent être rechargées dans un délai maximum de 48 heures sous peine de dommages irréversibles
- décharges journalières trop importantes : une longévité optimale est obtenue si les décharges journalières ne dépassent pas 16% de la capacité C100
- charge trop rapide (le courant de charge doit être limité à C/5)
- charge insuffisante (ne jamais laisser une batterie déchargée à plus de 50 % : recharger régulièrement la batterie à 100 %)
- surcharge (bouillonnement excessif qui entraîne une perte d'eau)
- température : la durée de vie d'une batterie est indiquée par le fabricant pour une température ambiante de 20°C
Cette durée de vie est réduite de moitié pour une élévation de température de 10°C - autodécharge (une batterie, même inutilisée, perd sa capacité d'autant plus rapidement que sa température de stockage est élevée : à 20°C, une batterie VRLA peut perdre chaque mois 5% de sa capacité, ce qui peut entraîner une décharge profonde)
Exemple
Une batterie a les caractéristiques suivantes : C20 = 95 Ah ; C100 = 105 Ah
Pour une longévité optimale, la décharge journalière ne doit pas dépasser 16% de C100 soit : 16 x 105 / 100 = 17 Ah
En utilisation exceptionnelle, la décharge ne doit pas dépasser 80% de C20 soit : 80 x 95 / 100 = 76 Ah
La loi de PEUKERT modélise la capacité d'une batterie en fonction du courant débité Cp = Ik x t
|
 |
Peukert Calculator |
Exemple
Capacité d'une batterie (caractérisée par Cp = 100 Ah et k = 1,1) pour un courant de décharge de 5 A, puis de 20 A
I1k x t1 = I2k x t2 = 100
t1 = 100/I1k = 100/51,1 = 17 h => C1 = 5 x 17 = 85 Ah
t2 = 100/I2k = 100/201,1 = 3,7 h => C2 = 20 x 3,7 = 74 Ah
Cette batterie est conçue pour les installations photovoltaïques autonomes La capacité peut être déterminée par la relation : C (Ah) = (E x N) / (L x U) avec : |
 |
Exemple Dans un site isolé, une batterie est rechargée le jour par des panneaux photovoltaïques E = 3 x 18 x 4 + 50 x 3 = 366 Wh/jour ; N = 5 ; L = 0,8 ; U = 12 V C = (366 x 5) / (0,8 x 12) = 190 Ah |
 |
Une batterie bien chargée a une tension supérieure à 2,1 x 6 = 12,6 V
Une batterie déchargée ou en mauvais état a une tension inférieure à 1,8 x 6 = 10,8 V
|
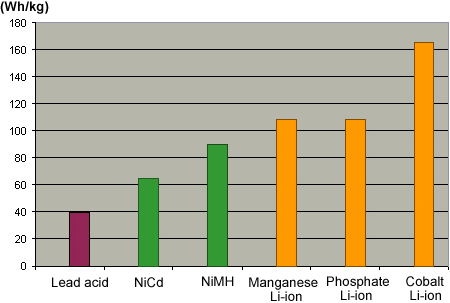 |
La batterie au plomb a une mauvaise puissance massique, Cependant, elle est encore très utilisée |
Une batterie déchargée avec un courant élevé peut se rétablir au bout d’un certain temps et la capacité restante peut être utilisée
Présentation (pdf 220 Ko)
Wikipédia (pdf 210 Ko)